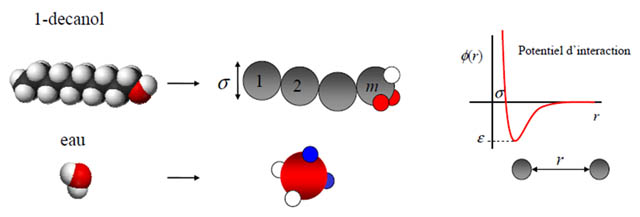
Modélisation avec l'approche SAFT
Les modèles de type SAFT sont des équations d'état basées sur une description à l'échelle moléculaire des constituants d'un mélange. Ces modèles sont issus de la théorie SAFT (Statistical Associating Fluid Theory) développée par W. G Chapman, G. Jackson, K. E. Gubbins and Radosz, Fluid Phase Equilib. (1989). Nous utilisons et développons au laboratoire ce type d'approches depuis plusieurs années.
Figure 1 : Description de l'eau et du 1-décanol selon l'approche SAFT. La non-sphéricité des molécules et les liaisons hydrogènes sont décrites de manière explicite par le modèle.
De nombreux systèmes peuvent être traités avec l'approche SAFT, tels que les solutions d'électrolytes, les mélanges d'hydrocarbures et les solutions de polymères. Ces modèles peuvent prédire les propriétés thermodynamiques des corps purs et des mélanges.
Contact : Patrice Paricaud, lecturer
Exemples d'applications de modèles effectués au laboratoire
Mélanges de réfrigérants
Les modèles de type SAFT sont bien adaptés aux mélanges de réfrigérants (composés polaires) car ils permettent de décrire les équilibres azéotropiques à haute pression.
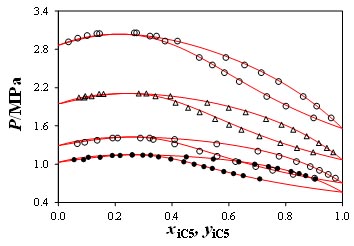
Figure 2 : Application de polar PC-SAFT au mélange isopentane + R245fa (1 kij pour toutes les températures).
D'après El Ahmar et al. Int. J. Refrig. (2012).
Acides Carboxyliques
Le terme associatif de SAFT a été modifié pour décrire de manière explicite la formation de dimères cycliques en phase vapeur (théorie de Sear et Jackson étendue aux mélanges), afin d'améliorer la description des enthalpies de vaporisation et les équilibres de phases des mélanges.
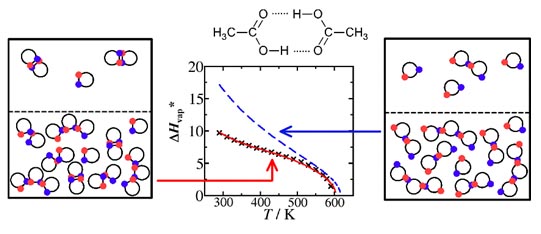
Figure 3 : Nouveau modèle associatif (courbe rouge) appliqué aux acides carboxyliques. Enthalpie de vaporisation de l'acide acétique.
D'après Janecek et Paricaud, J. Phys. Chem B. (2012).Solutions d'électrolytes
De nombreux systèmes d'électrolytes forts et faibles ont été étudiés au laboratoire avec diverses versions de SAFT (SAFT-VR (Galindo et col.) et PC-SAFT (Gross et col., Sadowski et col.). Nous avons par exemple utilisé SAFT-VR et développé une modèle thermodynamique pour décrire les conditions de formation des semi-chlathrates de gaz, actuellement étudiés comme solutions de séparation et de stockage de gaz.
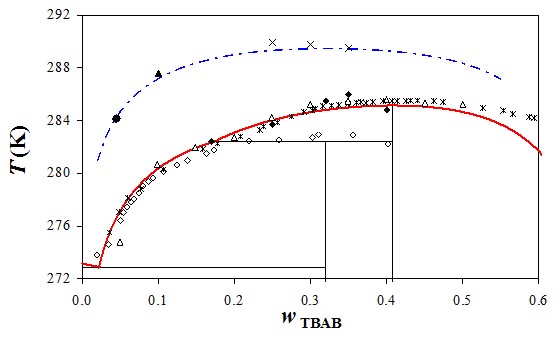
Figure 4 : Diagramme de phase température-composition du système TBAB + eau (courbe rouge) à P = 1 atm et TBAB + eau +CO2 (courbe bleue) à P = 2 MPa.
D'après Paricaud, J. Phys. Chem B (2011).
Autres exemples d'applications aux solutions d'électrolytes
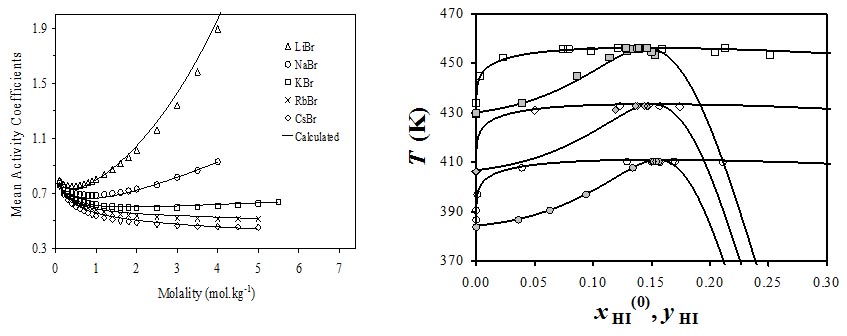
Figure 5 :
a) Description du coefficient d'activité moyen de divers électrolytes dans l'eau avec PC-SAFT électrolytes (Ho et col, 2012).
b) Description des équilibres phase liquide-vapeur du système HI+H2O.